Umweltschutz in unserem Inneren
Mikroben – sind das nicht die unsichtbaren Krankheitserreger, die im Schmutz leben? "Vor rund 20 Jahren begannen Mikrobiolog*innen, die Mikroben, die in, auf und überall um uns herum leben, mit neuen Technologien zu analysieren – und waren überrascht von der riesigen Zahl und Diversität der Organismen, die sie fanden", erklärt David Berry, der am Department für Mikrobiologie und Ökosystemwissenschaft vornehmlich am Mikrobiom der Darmflora forscht.
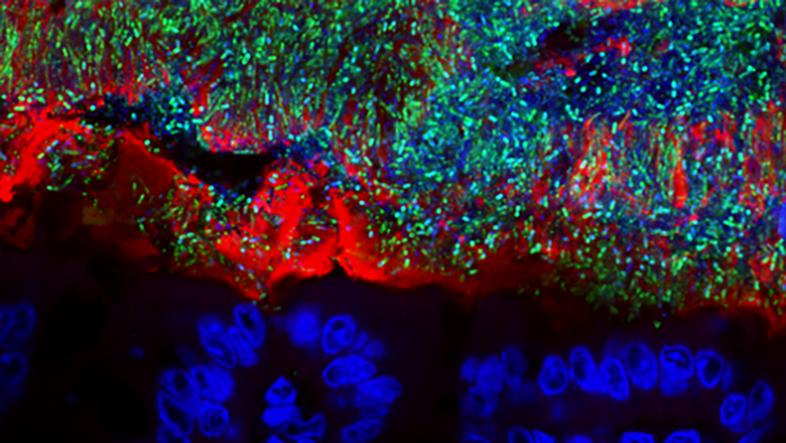
Zwei Erkenntnisse über Mikroben – ein Sammelbegriff für unterschiedlichste mikroskopisch kleine Lebewesen aus den Domänen der Bakterien, Archaeen und Eukaryoten – stellt der Mikrobiologe in den Vordergrund: Erstens, sie sind viele und sie sind überall. Im und am menschlichen Körper existieren mehr mikrobielle als menschliche Zellen, es gibt kaum eine Oberfläche, die nicht von ihnen überzogen ist. Und zweitens: "Die meisten Mikroben sind völlig unschädlich bis nützlich. Pathogene, also Krankheitserreger, sind stark in der Minderheit."
Die Rehabilitation der einstigen Bösewichte
Während vor allem Bakterien früher als "Bösewichte" angesehen wurden, erkannte man mit zunehmender Erforschung des Mikrobioms seit Anfang der 2000er-Jahre, dass viele Bakterien sogar notwendig für eine gesunde Entwicklung und ein gesundes Funktionieren des Körpers sind.
"Wir werden steril geboren, aber in den ersten zwei Wochen nehmen wir Mikroben auf, durch die Geburt sowie von der Umgebung, von anderen Menschen, Tieren, von Oberflächen. Unser Mikrobiom wird durch Muttermilch, Babymilch und durch die feste Nahrung in der Folge immer weiter beeinflusst", erklärt Berry. So erhalte jeder Mensch im Lauf der ersten zwei Lebensjahre einen individuellen "mikrobiellen Fingerabdruck".
Die Darmmikrobiom-Gehirn-Achse
Wie wichtig das sich so entwickelnde Mikrobiom ist, illustriert Berry am Beispiel von extremen Frühgeburten: "Die Zusammensetzung des Mikrobioms eines Babys einen Monat nach der Frühgeburt lässt bereits Schlüsse auf seine kognitive und soziale Fähigkeiten zwei Jahre später zu." Auch bei Erwachsenen ließe sich bei neurodegenerativen Erkrankungen und sogar bei Depressionen eine Veränderung des Mikrobioms beobachten.
In tierischen Modellen konnte dieser Zusammenhang noch klarer studiert werden: Es gibt Mäuselinien, die sich durch ihr scheues Verhalten auszeichnen und solche, die sehr neugierig sind. Wenn man deren Darmmikrobiom austausche, würden die scheuen Mäuse neugierig und die neugierigen scheu, schildert Berry sein "Lieblingsexperiment": "Der mikrobielle Phänotyp hat also einen Einfluss auf das Verhalten", ist Berry fasziniert.
In der Mikrobiomforschung nennt man diesen Zusammenhang die "Darmmikrobiom-Gehirn-Achse", und die Erforschung der dahinterstehenden Mechanismen ist aktuell ein heißes Thema in diesem Feld. Als wahrscheinlichen Kandidaten für einen Mittler handeln Mikrobiolog*innen wie Berry das Immunsystem.
Nach einem PhD in Umwelttechnik an der University of Michigan wechselte er 2009 an das Department of Microbiology and Ecosystem Science der Universität Wien. Er ist Mitglied des wissenschaftlichen Beirats der Österreichischen Mikrobiom-Initiative AMICI sowie im Board of Directors der Joint Microbiome Facility (JMF) der Universität Wien und der MedUni Wien.
Vom Schlachtfeld zum Garten
Denn mit dem Wandel der Sichtweise auf Bakterien änderte sich auch, wie Mikrobiolog*innen das Immunsystem betrachten. Berry: "Was vorher als Wächterin oder Tötungssystem von Eindringlingen angesehen wurde, sehen wir nun als Gärtnerin, die eine Balance zwischen der Funktion der Mikroben und des Körpers hält."
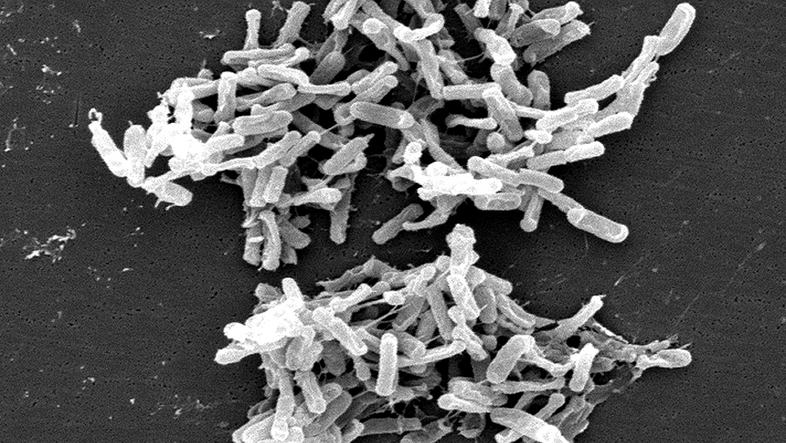
Und schließlich habe auch der Begriff der "pathogenen (krankheitserregenden) Bakterien" in diesem Zusammenhang einen Wandel durchgemacht. Denn wo unterschiedlichste Mikroben einen Platz im Garten unseres Körpers haben, seien Pathogene oft einfach Opportunisten, die unter bestimmten Umständen (des Immunsystems) gefährlich würden, in anderen Situationen aber wiederum harmlos seien. Als Beispiel nennt Berry "Clostridioides difficile". Dieser sogenannte "Krankenhauskeim" ist Verursacher der "CDI" genannten Infektion, einer wiederkehrenden und ernsthaften Durchfallerkrankung. "Viele Babies haben das Bakterium aber in ihrem Darm und zeigen keinerlei Krankheit", so der Mikrobiologe.
Wichtig dabei ist, wie CDI zustande kommt: Die meisten Patient*innen zögen sich CDI nämlich nach einer Behandlung mit Breitbandantibiotika zu. "Breitbandantibiotika zerstören nämlich, neben etwaigen 'Krankheitserregern', vor allem das nützliche Mikrobiom, das auch eine Schutzrolle innehat. Und in einem 'leeren Haus' kann sich C. diff. viel besser ausbreiten als in einem bereits gut bevölkerten", erklärt Berry.
Ein gesundes Mikrobiom in einem gesunden Körper
Das Mikrobiom ist also zentral für die Gesundheit des Körpers – vom Schutz vor der Ausbreitung einzelner Bakterien bis hin zur Gehirnfunktion. So entwickelten Mikrobiolog*innen die Idee, Patient*innen mit einem gestörten Mikrobiom durch die Transplantation eines gesunden Mikrobioms zu helfen. Diese als "Stuhltransplantation" bekannte Behandlung ist seit 2018 in den USA durch die Gesundheitsbehörde FDA anerkannt und wird seither unter sehr strengen Auflagen und mit peniblen Screening- und Reinigungsvorkehrungen erfolgreich und mit seltenen Nebenwirkungen angewandt.
Berry warnt aber vor einer undifferenzierten Verallgemeinerung der Idee, Menschen mögen sich vermehrt dem Mikrobiom anderer aussetzen: "Noch im 19. Jahrhundert gab es in den USA und in Europa immer wieder grassierende Typhus- und Cholera-Epidemien, die im Wesentlichen durch den Austausch von Fäkalien über Verunreinigungen, vor allem im Wasser, hervorgerufen wurden. Im frühen 20. Jahrhundert wurde das Trinkwasser chloriert und damit gingen auch diese Krankheitsfälle enorm zurück. Das sollten wir auch im Kopf behalten, wenn Leute sagen, dass unsere moderne Lebensweise 'zu steril' wäre, und einen 'ursprünglicheren' Lebensstil romantisieren."
All das wirft aber eine neue Frage auf: Was ist denn eigentlich ein gesundes Mikrobiom? Denn: "Vor dem Hintergrund der individuellen Interaktionen zwischen Körper und Mikrobiom kann es sein, dass eine bestimmte mikrobielle Zusammensetzung bei einem Menschen gut funktioniert, bei einem anderen aber zu Erkrankungen führt", erläutert Berry das Problem.
Dies sei aber vor allem eine Chance für individualisierte Medizin. Berry: "Wenn wir die Interaktionen zwischen Körper und Mikrobiom besser verstehen, könnten wir mit einem Blick auf das genetische Profil eine*r Patient*in sagen, welche Mikroben in einer bestimmten Situation hilfreich oder schädlich sind."
Der Feind meiner Feinde ist mein Freund
Wenn es aber darum geht, das Darmmikrobiom spezifisch zu steuern, brauche es neue Werkzeuge. Denn dass Antibiotika – so notwendig sie manchmal sind – auch das Potenzial haben, durch ihre undifferenzierte Wirkung großen Schaden im Mikrobiom anzurichten, ist bereits bekannt.
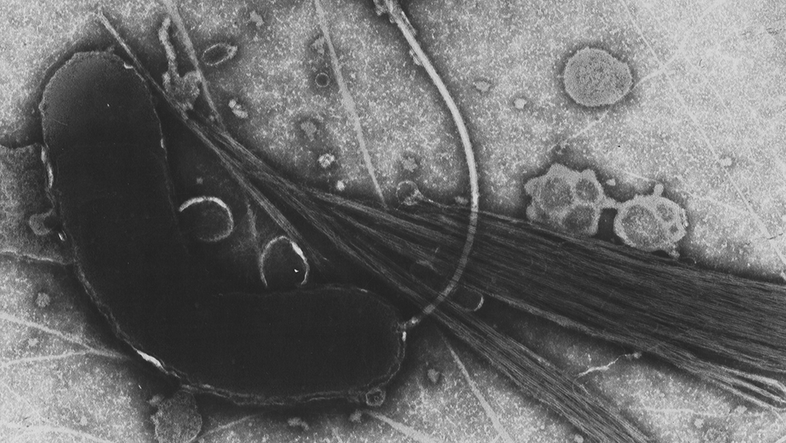
Als vielversprechenden neuen Weg sieht Berry die sogenannte "Phagentherapie": "Phagen sind Viren, die Bakterien infizieren. Dabei sind sie so spezifisch, dass sie einzelne bakterielle Stämme angreifen können und uns so die Möglichkeit in die Hand geben, beim Mikrobiom wirkliches Feintuning vorzunehmen." Aber nicht nur dort, wo Antibiotika zu viel Schaden anrichten, sieht Berry in der Phagentherapie Potenzial, sondern auch da, wo Antibiotika nichts mehr ausrichten können – also bei multiresistenten pathogenen Bakterien.
Mit grüner und roter Mikrobiologie das Ganze im Blick behalten
Bei multiresistenten pathogenen Bakterien schließt sich der Kreis zwischen der Umwelt, die in uns ist, und jener, die uns umgibt. Denn diese "Superkeime" entstehen durch Bakterien, die einerseits Antibiotika ausgesetzt sind und andererseits durch das Abwasser und vor allem durch die Viehwirtschaft in die Natur gelangen.
Berry zeichnet die Wirkfolge nach: "Die Bakterien, die ohnehin schon potenzielle menschliche Pathogene sind, kommen nun in Kontakt mit Bakteriengemeinschaften im Boden, die Resistenz-Gene für diese Antibiotika besitzen. Und durch den starken selektiven Druck, den die Unmengen an Antibiotika ausüben, ist es für die potenziellen pathogenen Bakterien vorteilhaft, die Resistenzen zu erwerben und dann auch weiterzugeben – bis sie irgendwann wieder auf den Menschen überspringen."
Und damit kommen auch zwei Forschungsbereiche miteinander in Verbindung, die bisher traditionell getrennt voneinander untersucht wurden: die "rote" Mikrobiologie, die sich mit medizinisch relevanten Mechanismen und Methoden beschäftigt, und die "grüne" Mikrobiologie, die ihren Fokus auf der Umwelt hat. "Genau das ist auch die Grundidee in unserem neuen Exzellenzcluster 'Microbiomes Drive Planetary Health'", erklärt der Mikrobiologe. "Wir wollen das Mikrobiom holistischer betrachten und die Wirkmechanismen der einzelnen Aspekte sowie die Methoden der verschiedenen Disziplinen integrieren." Denn egal, ob sie in uns ist oder um uns herum: Die Gesundheit der mikrobiellen Umwelt ist wesentlich für die Gesundheit der Menschen. (ds)